Зависимость свойств элементов от строения их атомов
На предыдущих уроках вы познакомились с тем, что такое атом, изучили строение его электронных оболочек и электронных орбиталей, а также узнали об изменениях в составе ядра и изотопах.
С каждым уроком информация становится все сложнее и насыщеннее, поэтому нужно быть как можно внимательнее и полностью концентрироваться на изучении нового материала.
Данный урок будет посвящен тому, как зависят свойства химических элементов от строения их атомов.
Инертные газы
Каждый из периодов Периодической системы химических элементов Д. И. Менделеева заканчивается инертным, или как их еще называют, благородным газом.
Наиболее распространенным из инертных (благородных) газов в атмосфере планеты Земля является аргон $Ar$. Его удалось выделить в чистом виде раньше других его «собратьев».
В чем же заключается причина инертности гелия $He$, неона $Ne$, аргона $Ar$, криптона $Kr$, ксенона $Xe$ и радона $Rn$?
Ответ прост: у атомов благородных газов на внешних, наиболее удаленных от ядра, энергетических уровнях находится восемь электронов. Кроме гелия $He$, у него их — два.
Восемь электронов на внешнем уровне — это максимальное число для каждого элемента таблицы химических элементов Д. И. Менделеева, кроме гелия $He$ и водорода $H$.
К такому идеалу прочности стремятся атомы всех химических элементов, представленных в Периодической системе.
Добиться подобного положения электронов атомы могут двумя способами:
- Отдав электроны с внешнего электронного уровня. Тогда внешний незавершенный уровень «пропадает», а предпоследний, который был завершен, становится внешним.
- Принять недостающие электроны на внешний электронный уровень, чтобы добиться устойчивой электронной оболочки с восемью электронами.
Атомы с меньшим числом электронов на внешнем уровне отдают их атомам с большим числом электронов на внешнем уровне.
Легко «делятся» своим одним электроном на внешнем уровне атомы элементов главной подгруппы I группы (IA группы).
Труднее отдают два электрона атомы элементов главной подгруппы II группы (IIA группы).
Еще неохотнее отдают свои три внешних электрона атомы элементов III группы главной подгруппы (IIIA группы): $B$, $Al$, $Ga$, $In$, $Tl$.
Атомы металлов и неметаллов
Тенденцию к отдаче электронов с внешнего уровня имеют атомы элементов-металлов.
Чем легче атомы металла отдают свои внешние электроны, тем в большей степени выражены у него металлические свойства.
Поэтому наиболее типичными металлами в Периодической системе химических элементов Д. И. Менделеева являются элементы главной подгруппы I группы (IA группы).
Тенденцию к принятию недостающих электронов до завершения внешнего энергетического уровня имеют атомы элементов-неметаллов.
Наиболее типичные неметаллы — элементы главной подгруппы VII группы (VIIA группы) Периодической системы Д. И. Менделеева.
На внешнем уровне атомов этих элементов имеется семь электронов. До устойчивого состояния атома, т. е. до восьми электронов на внешнем уровне, им не хватает только одного электрона. Они с легкостью его присоединяют, проявляя при этом неметаллические свойства.
На способность атомов отдавать или принимать электроны влияет не только число электронов на внешнем уровне, но и радиус атома.
В пределах периода с увеличением заряда атомного ядра (увеличением порядкового номера элемента), радиус атома постепенно уменьшается, а число внешних электронов — увеличивается. Поэтому металлические свойства химических элементов ослабевают, а неметаллические — усиливаются.

Как же ведут себя атомы элементов IV группы главной подгруппы (IVA группы) Периодической таблицы Д. И. Менделеева? У них на внешнем уровне четыре электрона, и, кажется, что все равно, отдать или принять недостающие четыре электрона.
В пределах одного периода количество энергетических уровней остается неизменным, а радиус атома уменьшается из-за увеличения числа протонов в ядре и, следственно, его положительного заряда.
Электроны начинают сильнее притягиваться к ядру, и атом как бы сжимается, поэтому отдать электроны становится все труднее, а принять недостающие — легче.
В пределах одной и той же подгруппы радиус атома увеличивается с увеличением заряда атомного ядра, т. к. при постоянном числе электронов на внешнем уровне (равно номеру группы) увеличивается число энергетических уровней (равно номеру периода). Атому становится легче отдать внешние электроны, его металлические свойства усиливаются, а неметаллические — ослабевают.

В Периодической системе химических элементов Д. И. Менделеева с увеличением порядкового номера свойства атомов химических элементов изменяются следующим образом:
| В пределах одной и той же группы (в главной подгруппе) металлические свойства усиливаются, а неметаллические — ослабевают, так как: | В пределах одного и того же периода металлические свойства ослабевают, а неметаллические — усиливаются, так как: |
| а) увеличиваются заряды атомных ядер; б) число электронов на внешнем уровне постоянно; в) увеличивается число заполняемых энергетических уровней; г) увеличивается радиус атома. | а) увеличиваются заряды атомных ядер; б) увеличивается число электронов на внешнем уровне; в) число заполняемых энергетических уровней постоянно; г) уменьшается радиус атома. |
ЗАДАНИЕ
Сравните строение и свойства атомов: а) углерода и кремния; б) кремния и фосфора.
Показать ответ
Скрыть ответ

Углерод $С$ и кремний $Si$ находятся в четвертой группе, поэтому у них четыре электрона на внешнем энергетическом уровне. Из этого можно сделать вывод, что данные химические элементы имеют схожие химические свойства. Но они располагаются в разных периодах: углерод $С$ — во втором, а кремний $Si$ — в третьем, поэтому радиус атома у кремния больше. Данный фактор оказывает влияние на металлические свойства, которые у кремния сильнее.
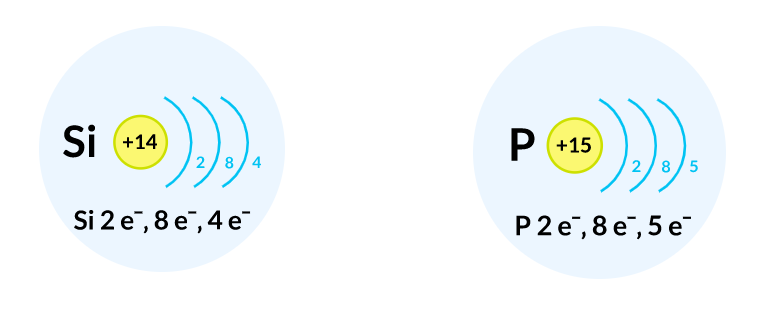
Кремний $Si$ и фосфор $Р$ находятся в третьем периоде, поэтому каждый из химических элементов имеет три энергетических уровня. Однако, они имеют разное количество электронов на внешнем уровне: кремний имеет четыре электрона, а фосфор — пять. В связи с этим неметаллические свойства проявляются сильнее у фосфора $Р$.
Оценить урок
Что можно улучшить?
Войдите, чтобы оценивать уроки
Что нужно исправить?
Отзыв отправлен. Спасибо, что помогаете нам стать лучше!
Для отправки комментария вам необходимо авторизоваться.
