Ионная химическая связь
Из предыдущих уроков вы узнали о электронных формулах, электронных орбиталях и о том, что свойства химических элементов также зависят от строения их атомов.
Пришло время познакомиться с новым для вас понятием химическая связь, она бывает: ионная, ковалентная (полярная и неполярная) и металлическая.
На данном уроке вы узнаете об одном из ее видов — ионной химической связи.
Химическая связь
Представьте, что «встретились» два атома: металла IA группы и неметалла VIIA группы. Атом металла имеет на внешнем энергетическом уровне один электрон, а атому неметалла как раз не хватает одного электрона до завершения внешнего уровня.
Рассмотрим этот случай на примере взаимодействия натрия $Na$ (металл) и хлора $Cl$ (неметалл).
Атом металла натрия $Na$ легко отдает свой один наиболее удаленный от ядра и слабо связанный с ним электрон атому неметалла хлору $Cl$.
Атом натрия $Na$ избавляется от одного отрицательного заряда и приобретет положительный заряд, а атом неметалла хлора $Cl$ благодаря полученному электрону превращается в отрицательно заряженный ион.
Ион — электрически заряженная частица, которая образуется в результате потери, либо присоединения электронов к атому.
Оба атома добились своего — получили восемь электронов на внешнем уровне, но что происходит дальше?
Противоположно заряженные ионы в соответствии с законом притяжения противоположных зарядов соединяются, т. е. между ними возникает химическая связь.
Химическая связь — это взаимодействие между электронами отдельных атомов элементов, приводящее к их прочной связи.
Между атомами натрия $Na$ и хлора $Cl$ образуется ионная химическая связь.
Ионная химическая связь
Ионная химическая связь — это химическая связь, образующаяся между противоположно заряженными ионами.
К примеру, ионная связь также образуется при взаимодействии атомов кальция $Ca$ и кислорода $О$.
Превращение атомов в ионы происходит всегда при взаимодействии атомов типичных металлов и неметаллов.
ЗАДАНИЕ 1
Рассмотрите схемы образования ионной связи между атомами химических элементов: а) калия и кислорода; б) лития и хлора.
Показать ответ
Скрыть ответ
а) Калий и кислород
Калий обладает типичными металлическими свойствами и имеет один электрон на внешнем уровне. Ему легче отдавать электрон.
$К^0-1ē\to \ К^{+}$
У кислорода шесть электронов на внешнем уровне и он обладает неметаллическими свойствами. Ему проще принять два электрона.
$О^0+2ē\to \ О^{2-}$
Общее кратное зарядов ионов 2, т. е. нужно два атома калия, которые отдадут два электрона атомам кислорода.Схематичное образование ионной связи:
$2К^0+О^0\to \ K^{+1}_2О^{-2} \to\ K_2O$б) Литий и хлор
Литий обладает типичными металлическими свойствами и имеет один электрон на внешнем уровне. Ему легче отдавать электрон.$Li^0-1ē\to \ Li^{+}$
У хлора семь электронов на внешнем уровне и он обладает неметаллическими свойствами. Ему проще принять один электрон.
$Cl^0+1ē\to \ Cl^{-}$
Общее кратное зарядов ионов 1, т. е. нужно один атом лития, который отдаст один электрон атому хлора.Схематичное образование ионной связи:
$Li^0+Cl^0\to \ Li^{+1}Cl^{-} \to\ LiCl$
Алгоритм записи схемы образования ионной связи
Предлагаем рассмотреть последовательность рассуждений при записи схемы образования ионной связи, например, между атомами магния $Mg$ и фтора $F$.
I) Магний $Mg$ — это элемент II группы главной подгруппы (IIA группы) Периодической системы химических элементов Д. И. Менделеева, металл. Его атому легче отдать два внешних электрона, чем принять недостающие шесть:
$Mg^0-2ē\to \ Mg^{2+}$
II) Фтор $F$ — это элемент VII группы главной подгруппы (VIIА группы) таблицы химических элементов Д. И. Менделеева, неметалл. Его атому легче принять один электрон для завершения внешнего энергетического уровня, чем отдать семь электронов:
$F^0+1ē\to \ F^-$
III) Найдите наименьшее общее кратное между зарядами образовавшихся ионов, оно равно $2(2\cdot1)$, т. е. нужно взять один атом магния $Mg$.
Затем определите, сколько атомов фтора F нужно взять, чтобы они могли принять два электрона (т. е. нужно взять два атома фтора $F$).
Схематично образование ионной связи между атомами магния и фтора выглядит так:
$Mg^0+2F^0\to\ Mg^{2+}F^-_2 $
Чтобы выразить состав ионных соединений, пользуются формульными единицами — аналогами молекулярных формул.
Цифры, показывающие число атомов, молекул или формульных единиц, называют коэффициентами, а цифры, показывающие число атомов в молекуле или ионов в формульной единице, называют индексами.
ЗАДАНИЕ 2
Назовите самый типичный металл и самый типичный неметалл Периодической системы химических элементов Д. И. Менделеева.
Показать ответ
Скрыть ответ
Самым типичным металлом в таблице Д. И. Менделеева является франций $Fr$, так как он находится в IA группе и в седьмом периоде, т. е. обладает наиболее сильными металлическими свойствами.
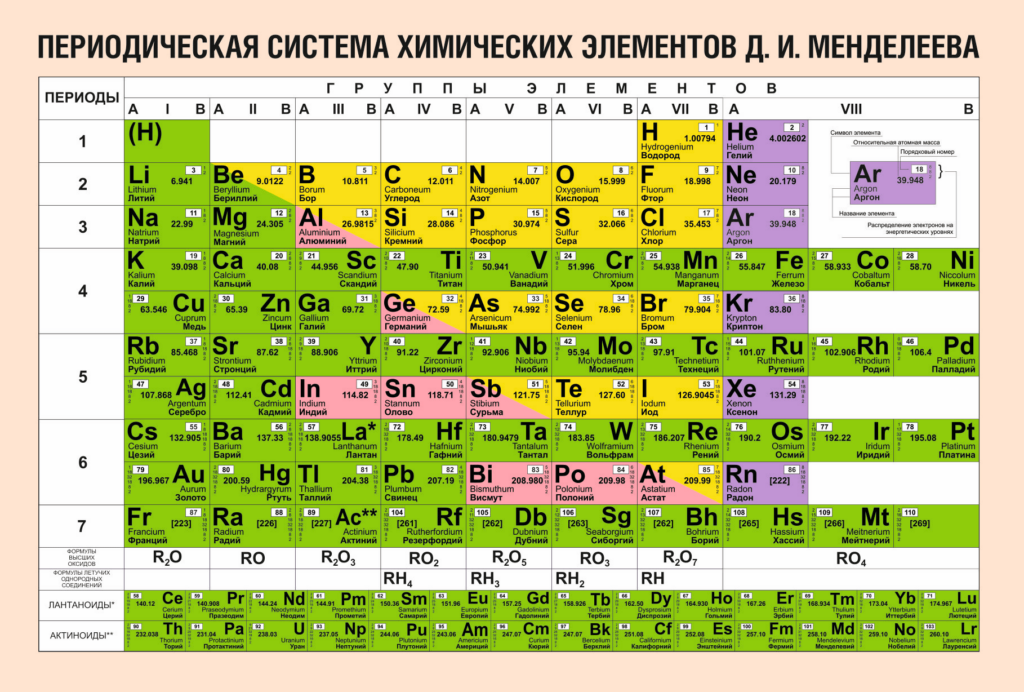
Самым типичным неметаллом в Периодической системе является фтор $F$, так как он находится в VIIA группе и во втором периоде, т. е. обладает наиболее сильными неметаллическими свойствами.

Хотите оставить комментарий?
Войти