Строение атома: электронные формулы, электронные орбитали
На предыдущем уроке вы познакомились с первой частью темы о строении электронных оболочек. Вы узнали, что собой представляют электронные оболочки атомов, что такое электронные слои и как они заполняются.
Данный урок представляет вторую часть темы о строении электронных оболочек. Здесь информация будет посвящена электронным формулам и электронным орбиталям.
Электронные формулы
Электронная формула — это формула расположения электронов по различным электронным оболочкам атома химического элемента.
Ядро атома водорода имеет заряд $+1$, т. е. содержит только один протон, соответственно и один электрон на одном энергетическом уровне.
Это можно записать с помощью электронной формулы: $_1Н 1ē$, где нижний индекс — число протонов в ядре, а запись $1ē$ — число электронов.
Следующим элементом первого периода является гелий. Ядро атома гелия имеет заряд $+2$. У него на первом энергетическом уровне имеются уже два электрона $_2Не 2ē$.
Первый энергетический уровень может вместить только два электрона, поэтому он полностью завершен. Потому первый период таблицы химических элементов Д. И. Менделеева состоит только из двух элементов.
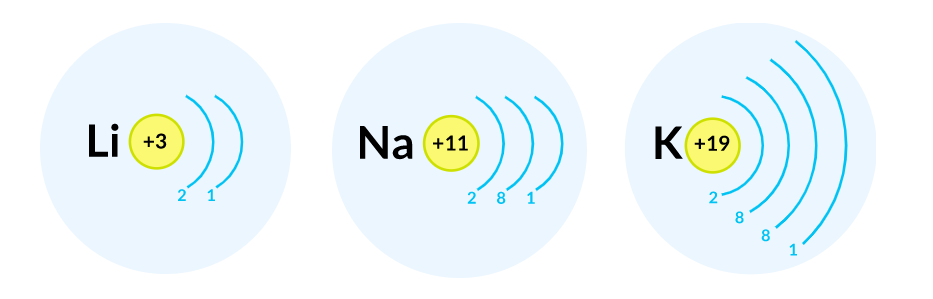
У атома лития, элемента второго периода, появляется дополнительный энергетический уровень, туда и «отправляется» третий электрон $_3Li 2ē, 1ē$.
У атома бериллия на второй уровень «попадает» еще один электрон $_4Be 2ē, 2ē$.
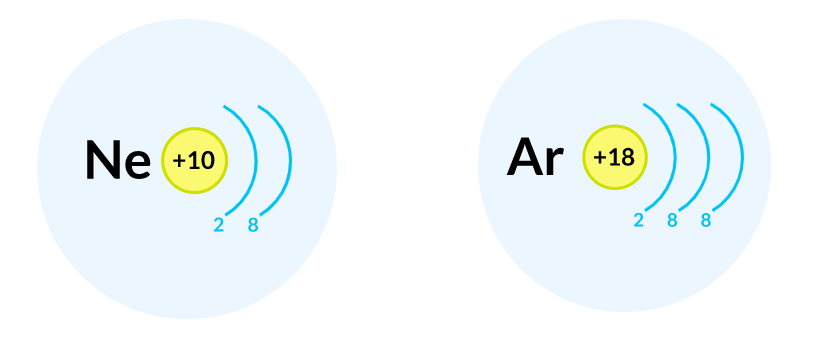
У атома бора на внешнем уровне — три электрона, а у атому углерода — четыре; атом фтора имеет семь электронов на внешнем уровне, а атом неона — восемь электронов $_{10}Ne 2ē, 8ē$.
На втором уровне может поместиться только восемь электронов, поэтому он у неона завершен.
Натрий — элемент третьего периода, у него появляется еще один, третий энергетический уровень, и на нем находится один электрон $_{11}Na 2ē, 8ē, 1ē$.
Обратите внимание: натрий — элемент третьего периода, поэтому его атом содержит три энергетических уровня. Также это элемент I группы главной подгруппы, поэтому на внешнем энергетическом уровне у него один электрон!
Предлагаем также рассмотреть строение энергетических уровней атома серы, элемента VIA группы третьего периода $_{16}S 2ē, 8ē, 6ē$.
Завершающим в третьем периоде является атом аргона $_{18}Ar 2ē, 8ē, 8ē$.
Атомы химических элементов четвертого периода соответственно имеют четвертый уровень, на котором у атома калия, например, находится один электрон.
ЗАДАНИЕ 1
Изобразите схемы строения электронной оболочки атомов: а) алюминия; б) фосфора; в) кислорода.
Показать ответ
Скрыть ответ
ЗАДАНИЕ 2
Сравните строение электронной оболочки атомов: а) азота и фосфора; б) фосфора и серы.
Показать ответ
Скрыть ответ
Строение электронных оболочек азота и фосфора схожи количеством электронов на внешнем энергетическом уровне. Однако, у азота два уровня, а у фосфора — три.
У фосфора и серы одинаковое количество энергетических уровней — по три, но различное количество электроном на внешнем энергетическом уровне: у фосфора — пять, а у серы — шесть.
Электронные орбитали
Теперь, когда у вас имеются элементарные представления о строении атомов первого и второго периодов таблицы химических элементов Д. И. Менделеева, введем уточнения, которые приблизят вас к более правильному и корректному взгляду на строение атома.
Аналогично тому, как быстро движущаяся игла татуировочной машинки, прокалывая кожу, вырисовывает на ней рисунок, так же неизмеримо быстро движущийся в пространстве вокруг атомного ядра электрон «рисует» изображение электронного облака, только не плоское, а объемное.
Скорость движения электрона в сотни тысяч раз больше скорости движения иглы тату-машинки, поэтому говорят о вероятности нахождения электрона в том или ином месте пространства.
Если удастся установить положение электрона в одном из мест возле ядра и отметить это положение точкой, то, проведя это действие около тысячи раз, можно получить модель электронного облака.
Электронные облака называют орбиталями. Электронные орбитали отличаются размерами, это зависит от энергии. Чем меньше запас энергии электрона, тем сильнее он притягивается к ядру и тем меньше по размеру его орбиталь.
Электронная орбиталь (электронное облако) — это пространство вокруг ядра атома, где наиболее вероятно может находиться данный электрон.
ФАКТЫ
В 1922 году В. Брюсов написал стихотворение «Мир электрона»:
Быть может, эти электроны - Миры, где пять материков, Искусства, званья, войны, троны И память сорока веков. Еще, быть может, каждый атом - Вселенная, где сто планет; Там все, что здесь, в объеме сжатом, Но также то, чего здесь нет.
Прочитав вдумчиво это стихотворение, можно сделать выводы о научных открытиях того времени.
Автор сравнил атомы со Вселенной, соответственно, так он объясняет планетарную модель строения атома, также просматриваются предположения о том, что электрон — это сложная частица.
Электронные орбитали имеют разную форму. Каждый энергетический уровень в атоме начинается с $s$-орбитали сферической формы. На втором и последующих уровнях после s-орбитали появляются $p$-орбитали гантелеобразной формы.
P-орбиталей три. Любую из этих орбиталей занимают не более двух электронов. Соответственно, на $s$-орбитали их может быть только два, а на трех $p$-орбиталях — шесть.
Полная запись электронных формул
Более полные электронные формулы строения атомов записывают следующим образом:
а) энергетический уровень обозначают в виде коэффициента арабской цифрой;
б) далее буквами $s$ и $p$ обозначают орбиталь;
в) число электронов каждой орбитали записывают в виде верхнего индекса справа над буквой.
Например, электронные формулы атомов первого периода:
$H$ — $1s^1$; $He$ — $1s^2$.
И электронные формулы атомов второго периода:
$Li$ — $1s^22s^1$; $Be$ — $1s^22s^2$; $B$ — $1s^22s^22p^1$; $C$ — $1s^22s^22p^2$; $N$ — $1s^22s^22p^3$; $O$ — $1s^22s^22p^4$; $F$ — $1s^22s^22p^5$; $Ne$ — $1s^22s^22p^6$.
Если элементы имеют сходные по строению внешние энергетические уровни, то и их свойства будут подобны.
К примеру, неон и аргон содержат на внешнем уровне по восемь электронов, поэтому они инертны, то есть практически не вступают в химические реакции. В свободном виде неон и аргон — это газы, их молекулы одноатомны.
Литий, натрий и калий содержат на внешнем уровне по одному электрону и обладают сходными свойствами, поэтому они помещены в одну группу Периодической системы Д. И. Менделеева.
Одинаковое строение внешних энергетических уровней периодически повторяется, с этим связано периодическое повторение свойств химических элементов. Эта закономерность отражается в названии Периодической системы химических элементов Д. И. Менделеева.
ЗАДАНИЕ 3
Определите положение химического элемента в Периодической системе Д. И. Менделеева по его электронной формуле: а) $2ē, 8ē$; б) $2ē, 8ē, 4ē$.
Показать ответ
Скрыть ответ
а) Элемент находится во втором периоде в восьмой группе. Эту информацию можно получить исходя из того, что у элемента два энергетических уровня и 8 электронов на внешнем уровне. Соответственно, это неон $Ne$.
б) Этот элемент кремний $Si$. У атома химического элемента три энергетических уровня, следовательно, он располагается в третьем периоде. Четыре электрона на внешнем уровне указывают на то, что элемент находится в четвертой группе, в главной подгруппе.
Оценить урок
Что можно улучшить?
Войдите, чтобы оценивать уроки
Что нужно исправить?
Отзыв отправлен. Спасибо, что помогаете нам стать лучше!
Для отправки комментария вам необходимо авторизоваться.
