Строение атома: электронная оболочка, электронные слои
Из предыдущих уроков вы узнали, что сердцем атома является его ядро, в составе которого могут происходить различные изменения.
Микро- и макромир
Вокруг ядра двигаются электроны. Электроны не могут без движения, иначе они сразу же упали бы на ядро.
Вам известно, что в начале XX века ученые приняли планетарную модель строения атома.
Согласно этой модели, отрицательно заряженные электроны вращаются вокруг положительно заряженного ядра, как в Солнечной системе планеты — вокруг Солнца.
Но как показали многочисленные исследования ученых, строение атома оказалось гораздо сложнее. Вопрос о строении атома остается открытым и актуальным даже для современной науки.
Атомы, молекулы и другие элементарные частицы относятся к объектам микромира, который мы не можем непосредственно наблюдать. В этом мире царствуют свои законы и правила, отличающиеся от макромира.
Микромир — это мир предельно малых, не наблюдаемых нами объектов.
Макромир — это мир объектов, которые человек может наблюдать непосредственно или с помощью приборов (микроскоп и т. д.).
Обращаем ваше внимание, что далее, изучая строение электронных оболочек атомов, стоит понимать, что вы в своем воображении представляете модель, которая в большей степени соответсвует современным взглядам. Для лучшего усвоения, мы предлагаем вам упрощенную, но актуальную модель.
Электронная оболочка атома
Электронная оболочка — это совокупность всех электронов в атоме, движущихся вокруг ядра.
Число электронов в оболочке атома равно числу протонов в ядре, ему соответствует атомный номер элемента в таблице Д. И. Менделеева.
Например, электронная оболочка магния состоит из двенадцати электронов, водорода — из одного, кальция — из двадцати.
Возникает вопрос, как движутся электроны вокруг ядра? Есть ли определенный порядок движения или все происходит хаотично? Как выяснилось, движение электронов вокруг ядра происходит в определенном порядке.
В атоме электроны различаются по энергии. По опытным данным исследователи определили, что одни из них притягиваются к атому слабее, а другие — сильнее.
Основной причиной этого является разное удаление электронов от ядра атома. Чем ближе электрон к ядру, тем прочнее их связь, и тем сложнее «вырвать» его из электронной оболочки. Соответственно, чем дальше электрон от ядра, тем легче его «оторвать».
По мере удаления от ядра атома запас энергии электрона ($Е$) увеличивается.
Электронные слои (энергетические уровни)
Движущиеся вблизи ядра электроны экранируют, т. е. загораживают собой ядро от других электронов, имеющих более слабое притяжение к ядру и движущихся на большем расстоянии от него.
Таким образом возникают электронные слои в электронной оболочке атома. Каждый из электронных слоев состоит из электронов, близких по энергетическим значениям. Исходя из этого, электронные слои также называют энергетическими уровнями.
Электронный слой (энергетический уровень) — это совокупность электронов с близкими значениями энергии.

Число энергетических уровней в атоме, заполняемых электронами, равно номеру периода, в котором находится химический элемент в Периодической таблице Д. И. Менделеева.
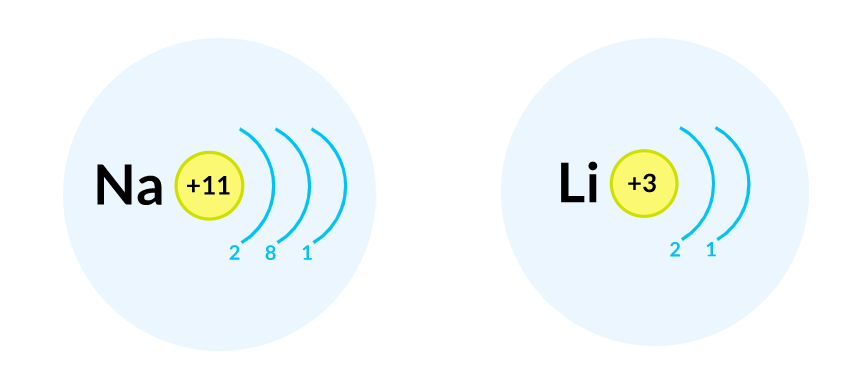
Соответственно, электронная оболочка атомов пятого периода содержит пять энергетических уровней, третьего периода — три, второго — два и т. д. Например, в атоме натрия она состоит из трех энергетических уровней, а в атоме лития — из двух.
Наибольшее число электронов на энергетическом уровне можно вычислить по формуле:
$2n^2$, где $n$ — номер уровня.
Так, первый энергетический уровень заполнен при наличии на нем двух электронов ($2\cdot1^2 = 2$); второй — при наличии восьми электронов ($2\cdot2^2 = 8$); третий — восемнадцати ($2\cdot3^2 = 18$) и т. д.
Число электронов на внешнем энергетическом уровне электронной оболочки атома для химических элементов главных подгрупп равно номеру группы.
Для удобства при составлении схемы строения электронных оболочек атомов, рекомендуем пользоваться планом:
а) определите общее число электронов на оболочке по порядковому номеру элемента;
б) определите число заполняемых электронами энергетических уровней в электронной оболочке по номеру периода;
в) определите число электронов на каждом энергетическом уровне (на первом — не больше двух электронов; на втором — не больше восьми, а для элементов главным подгрупп число электронов на внешнем уровне равно номеру группы).
ЗАДАНИЕ
Впишите пропущенные слова в предложения:
«Атом кремния содержит в ядре … протонов и … нейтронов. Число электронов, находящихся вокруг ядра, как и число протонов, равно … элемента. Число энергетических уровней определяется номером … и равно … . Число электронов на внешнем электронном слое определяется номером … и равно …».
Показать ответ
Скрыть ответ
Атом кремния содержит в ядре 14 протонов и 14 нейтронов. Число электронов, находящихся вокруг ядра, как и число протонов, равно порядковому номеру элемента. Число энергетических уровней определяется номером периода и равно 3 . Число электронов на внешнем электронном слое определяется номером группы и равно 4.
Часто задаваемые вопросы
Количество элементов в периоде определяется количеством электронов, которые могут размещаться на внешнем энергетическом уровне и определяется формулой $2n^2$, где n — это номер периода. Соответственно, в первом периоде два элемента (два электрона на внешнем уровне), во втором периоде — 8 элементов (восемь электронов на внешнем уровне).
В математике — это периодичность изменения функций синуса и косинуса; в биологии — биоритмы; в географии — смена дня и ночи, приливы и отливы, смена времен года.
Оценить урок
Что можно улучшить?
Войдите, чтобы оценивать уроки
Что нужно исправить?
Отзыв отправлен. Спасибо, что помогаете нам стать лучше!
Для отправки комментария вам необходимо авторизоваться.
